 La Comisión Europea (CE) ha otorgado este miércoles una licencia condicional a Moderna para el uso en los países europeos de su vacuna contra el COVID-19, solo unas horas después de que la Agencia Europea del Medicamento (EMA) haya respaldado el fármaco. “Hemos autorizado la vacuna de Moderna, la segunda vacuna aprobada en la UE”, ha escrito en Twitter la presidenta de la Comisión Europea, Ursula von der Leyen.
La Comisión Europea (CE) ha otorgado este miércoles una licencia condicional a Moderna para el uso en los países europeos de su vacuna contra el COVID-19, solo unas horas después de que la Agencia Europea del Medicamento (EMA) haya respaldado el fármaco. “Hemos autorizado la vacuna de Moderna, la segunda vacuna aprobada en la UE”, ha escrito en Twitter la presidenta de la Comisión Europea, Ursula von der Leyen.
 La luz verde de Bruselas a la comercialización y uso del tratamiento de Moderna llega tan solo tres horas después de que la EMA haya otorgado la autorización condicional de comercialización en mayores de 18 años y la considere lo suficientemente segura y eficaz. Esto aumentará el número de dosis distribuidas en los estados miembros, en un momento en el que los retrasos y problemas en el despliegue de las vacunas ha suscitado críticas de algunos estados miembros.
La luz verde de Bruselas a la comercialización y uso del tratamiento de Moderna llega tan solo tres horas después de que la EMA haya otorgado la autorización condicional de comercialización en mayores de 18 años y la considere lo suficientemente segura y eficaz. Esto aumentará el número de dosis distribuidas en los estados miembros, en un momento en el que los retrasos y problemas en el despliegue de las vacunas ha suscitado críticas de algunos estados miembros.
El comité de medicamentos humanos (CHMP) se ha reunido este miércoles y ha concluido de forma positiva su evaluación de todo el paquete de datos compartidos por Moderna, que incluía información sobre el proceso de producción, la calidad, los ingredientes, y los datos del ensayo clínico llevado a cabo por la farmacéutica.
El respaldo por la EMA era el paso previo a que la Comisión aprobase la Autorización de Comercialización Condicional (CMA, en sus siglas en inglés) para Moderna y la convirtiera en la segunda que podrá usarse en los países europeos después del fármaco de Pfizer/BioNtech, autorizado el 21 de diciembre.
Europa ha adquirido 160 millones de dosis
En virtud de los contratos firmados con la farmacéutica estadounidense, la Comisión Europea ha adquirido 160 millones de dosis de la vacuna de Moderna, 80 de ellas fijas y otras tantas opcionales.
 De esta forma, el Ejecutivo comunitario continúa comprometido con acortar todos los procedimientos para conceder rápidamente la autorización de las vacunas, cuando el proceso normalmente requiere 67 días.
De esta forma, el Ejecutivo comunitario continúa comprometido con acortar todos los procedimientos para conceder rápidamente la autorización de las vacunas, cuando el proceso normalmente requiere 67 días.
Como ha recordado Von der Leyen, la Comisión Europea tiene comprometidas 2.000 millones de dosis de las potenciales vacunas, lo que debería ser más que necesario para proteger a la población de la UE y cumplir con los compromisos internacionales adquiridos por el bloque.
Por su parte, la comisaria de Salud, Stella Kyriakides, ha indicado que más vacunas seguirán a la de Pfizer y Moderna. “Nuestros esfuerzos no cesarán hasta que las vacunas estén disponibles para todos en la UE”, ha señalado, recomendando que mientras se produzca la campaña de vacunación conviene tener paciencia y mantenerse disciplinados y vigilantes.
En palabras del director ejecutivo de la EMA, Emer Cooke, la vacuna de la empresa estadounidense supone “otra herramienta para superar la emergencia actual”. “Que tengamos esta segunda recomendación de una vacuna positiva en poco menos de un año desde que la Organización Mundial de la Salud declarara la pandemia, es un ejemplo de los esfuerzos y el compromiso adquirido por todos”, ha recalcado.
Esta vacuna, ya autorizada en Estados Unidos, Canadá e Israel, obtiene una licencia acompañada de condiciones similares a las que se piden desde el 21 de diciembre a Pfizer, que exigen a la empresa seguir investigando y compartiendo informes mensuales con la EMA hasta que logre pedir una licencia oficial final.
Illa: “Estamos de enhorabuena”
 De esta forma, la EMA ha recomendado por consenso que la Comisión Europea conceda una autorización de comercialización condicional formal, como ya lo hizo hace unas semanas con la vacuna de Pfizer y BioNTech. En el caso de la vacuna norteamericana se administra en dos inyecciones en el brazo, con 28 días de diferencia. Los efectos secundarios más comunes de la vacuna han sido generalmente leves o moderados y mejoraron unos días después de la vacunación.
De esta forma, la EMA ha recomendado por consenso que la Comisión Europea conceda una autorización de comercialización condicional formal, como ya lo hizo hace unas semanas con la vacuna de Pfizer y BioNTech. En el caso de la vacuna norteamericana se administra en dos inyecciones en el brazo, con 28 días de diferencia. Los efectos secundarios más comunes de la vacuna han sido generalmente leves o moderados y mejoraron unos días después de la vacunación.
Von der Leyen también celebró en Twitter el resultado de la reunión como una “buena noticia” para los “esfuerzos” por traer más vacunas para los europeos. “Ahora trabajamos a toda velocidad para aprobarla y validarla en la Unión Europea”, dijo.
También el ministro de Sanidad, Salvador Illa, ha recibido la noticia asegurando que “estamos de enhorabuena” y que se trata de “un paso más hacia el fin de la pandemia”.
“Esta vacuna nos brinda otra herramienta para superar la emergencia actual. Que tengamos esta segunda recomendación de una vacuna positiva en poco menos de un año desde que la Organización Mundial de la Salud declarara la pandemia, es un ejemplo de los esfuerzos y el compromiso adquirido por todos”, ha dicho por su parte el director ejecutivo de la EMA, Emer Cooke.
Un ensayo clínico con 30.000 personas y eficacia del 90%
La decisión se ha basado en los resultados de un ensayo clínico con 30.000 personas de entre 18 y 94 años que no tenían signos de infección previa de Covid-19. En el mismo, se observó una reducción del 94,1 por ciento en el número de casos sintomáticos de Covid-19 en las personas que recibieron la vacuna, en comparación con las personas que recibieron inyecciones simuladas (185 de 14.073 personas).
 Asimismo, el ensayo también mostró una eficacia del 90,9% en participantes con riesgo de COVID-19 grave, incluidos aquellos con enfermedad pulmonar crónica, enfermedad cardiaca, obesidad, enfermedad hepática, diabetes o infección por VIH. La alta eficacia también se mantuvo en todos los géneros, grupos raciales y étnicos.
Asimismo, el ensayo también mostró una eficacia del 90,9% en participantes con riesgo de COVID-19 grave, incluidos aquellos con enfermedad pulmonar crónica, enfermedad cardiaca, obesidad, enfermedad hepática, diabetes o infección por VIH. La alta eficacia también se mantuvo en todos los géneros, grupos raciales y étnicos.
La vacuna de Moderna se administra en dos inyecciones en el brazo, con 28 días de diferencia. Los efectos secundarios más comunes de la vacuna han sido generalmente leves o moderados y mejoraron unos días después de la vacunación. Estos son dolor e hinchazón en el lugar de la inyección, cansancio, escalofríos, fiebre, ganglios linfáticos inflamados o sensibles debajo del brazo, dolor de cabeza, dolor muscular y articular, náuseas y vómitos.
La EMA ha asegurado que la seguridad y eficacia de la vacuna se seguirá controlando a medida que se utilice en toda la Unión Europea (UE), a través del sistema de farmacovigilancia de la UE y estudios adicionales realizados por la empresa y las autoridades europeas.
![]() El laboratorio estadounidense Moderna va a presentar a comienzos de junio una demanda de autorización a la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) para que su vacuna pueda ser utilizada para los adolescentes de 12 a 17 años.
El laboratorio estadounidense Moderna va a presentar a comienzos de junio una demanda de autorización a la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) para que su vacuna pueda ser utilizada para los adolescentes de 12 a 17 años. Su consejero delegado, el francés Stéphane Bancel, lo anuncia en una entrevista al ‘Le Journal du Dimanche‘, en la que justifica la rápida apertura de la vacunación para ese grupo de edad para protegerse con la inmunidad colectiva ante el riesgo de una eventual nueva ola epidémica.
Su consejero delegado, el francés Stéphane Bancel, lo anuncia en una entrevista al ‘Le Journal du Dimanche‘, en la que justifica la rápida apertura de la vacunación para ese grupo de edad para protegerse con la inmunidad colectiva ante el riesgo de una eventual nueva ola epidémica. El consejero delegado reitera sus críticas a la Unión Europea por su “falta de anticipación” en los primeros meses de la pandemia para trabajar con los laboratorios en las vacunas. Dice que puso presión a la Comisión Europea -sin éxito- para que les hiciera un avance y poder lanzar así la producción en el Viejo Continente rápidamente, como ocurrió en Estados Unidos, cuya Administración se movilizó desde la primavera de 2020, pero con Bruselas no se consiguió hasta la firma del contrato en novembre.
El consejero delegado reitera sus críticas a la Unión Europea por su “falta de anticipación” en los primeros meses de la pandemia para trabajar con los laboratorios en las vacunas. Dice que puso presión a la Comisión Europea -sin éxito- para que les hiciera un avance y poder lanzar así la producción en el Viejo Continente rápidamente, como ocurrió en Estados Unidos, cuya Administración se movilizó desde la primavera de 2020, pero con Bruselas no se consiguió hasta la firma del contrato en novembre.








 Según especifica el documento, en cualquier caso, no será necesaria la realización de pruebas serológicas ni antes ni después de estas vacunaciones para verificar si se poseen anticuerpos contra la Covid-19.
Según especifica el documento, en cualquier caso, no será necesaria la realización de pruebas serológicas ni antes ni después de estas vacunaciones para verificar si se poseen anticuerpos contra la Covid-19. El documento de estrategia de vacunación apunta que con las vacunas de AstraZeneca, una vez completada la vacunación a colectivos con función esencial para la sociedad ya priorizados, se administrará a las personas de entre 45 y 55 años de edad, que serán considerados el grupo 9.
El documento de estrategia de vacunación apunta que con las vacunas de AstraZeneca, una vez completada la vacunación a colectivos con función esencial para la sociedad ya priorizados, se administrará a las personas de entre 45 y 55 años de edad, que serán considerados el grupo 9.
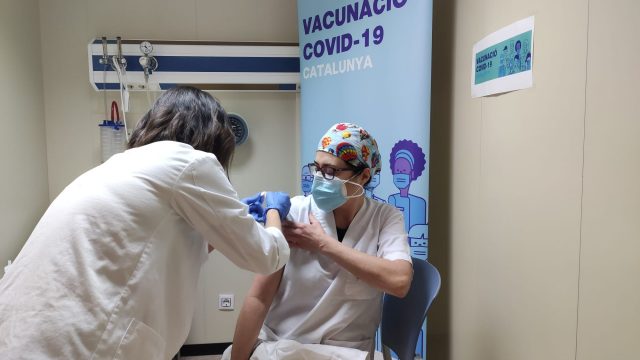 Avui comença la vacunació de 31.780 professionals farmacèutics o de serveis essencials com bombers, policia, protecció civil i funcionaris penitenciaris. Així ho va anunciar ahir la consellera de Salut, Alba
Avui comença la vacunació de 31.780 professionals farmacèutics o de serveis essencials com bombers, policia, protecció civil i funcionaris penitenciaris. Així ho va anunciar ahir la consellera de Salut, Alba 
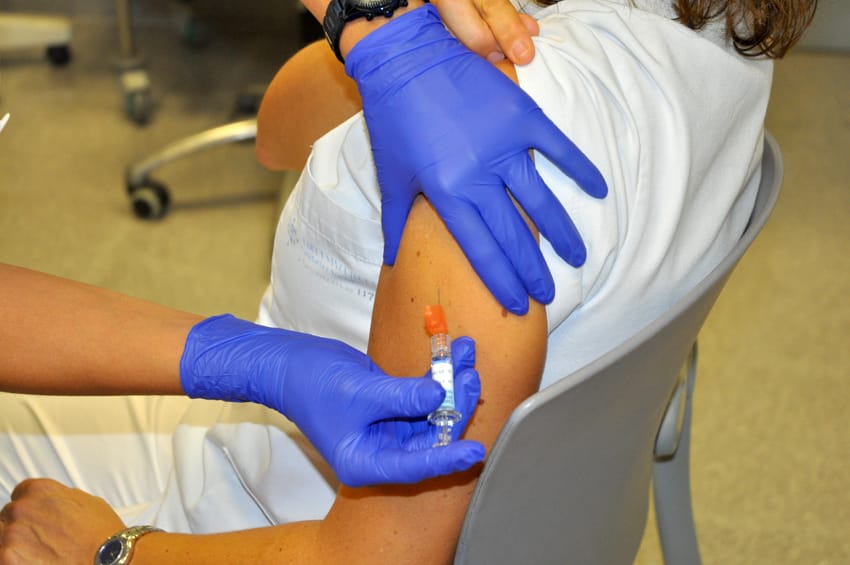
 La luz verde de Bruselas a la comercialización y uso del tratamiento de Moderna llega tan solo tres horas después de que la EMA haya otorgado la autorización condicional de comercialización en mayores de 18 años y la considere lo suficientemente segura y eficaz. Esto aumentará el número de dosis distribuidas en los estados miembros, en un momento en el que los retrasos y problemas en el despliegue de las vacunas ha suscitado críticas de algunos estados miembros.
La luz verde de Bruselas a la comercialización y uso del tratamiento de Moderna llega tan solo tres horas después de que la EMA haya otorgado la autorización condicional de comercialización en mayores de 18 años y la considere lo suficientemente segura y eficaz. Esto aumentará el número de dosis distribuidas en los estados miembros, en un momento en el que los retrasos y problemas en el despliegue de las vacunas ha suscitado críticas de algunos estados miembros. De esta forma, el Ejecutivo comunitario continúa comprometido con acortar todos los procedimientos para conceder rápidamente la autorización de las vacunas, cuando el proceso normalmente requiere 67 días.
De esta forma, el Ejecutivo comunitario continúa comprometido con acortar todos los procedimientos para conceder rápidamente la autorización de las vacunas, cuando el proceso normalmente requiere 67 días. De esta forma, la EMA ha recomendado por consenso que la Comisión Europea conceda una autorización de comercialización condicional formal, como ya lo hizo hace unas semanas con la vacuna de Pfizer y BioNTech. En el caso de la vacuna norteamericana se administra en dos inyecciones en el brazo, con 28 días de diferencia. Los efectos secundarios más comunes de la vacuna han sido generalmente leves o moderados y mejoraron unos días después de la vacunación.
De esta forma, la EMA ha recomendado por consenso que la Comisión Europea conceda una autorización de comercialización condicional formal, como ya lo hizo hace unas semanas con la vacuna de Pfizer y BioNTech. En el caso de la vacuna norteamericana se administra en dos inyecciones en el brazo, con 28 días de diferencia. Los efectos secundarios más comunes de la vacuna han sido generalmente leves o moderados y mejoraron unos días después de la vacunación. Asimismo, el ensayo también mostró una eficacia del 90,9% en participantes con riesgo de COVID-19 grave, incluidos aquellos con enfermedad pulmonar crónica, enfermedad cardiaca, obesidad, enfermedad hepática, diabetes o infección por VIH. La alta eficacia también se mantuvo en todos los géneros, grupos raciales y étnicos.
Asimismo, el ensayo también mostró una eficacia del 90,9% en participantes con riesgo de COVID-19 grave, incluidos aquellos con enfermedad pulmonar crónica, enfermedad cardiaca, obesidad, enfermedad hepática, diabetes o infección por VIH. La alta eficacia también se mantuvo en todos los géneros, grupos raciales y étnicos.


